Índice:
- ¿Qué es la farmacovigilancia?
- ¿Por qué es importante la farmacovigilancia?
- ¿Cuáles son las etapas de la farmacovigilancia?
- Ejemplos de farmacovigilancia
- Estructura digital, automatización y trazabilidad
- Digitalización, clasificación, recuperación y seguridad
- ¿Quién participa en la farmacovigilancia?
- Fórmate en farmacovigilancia
¿Qué es la farmacovigilancia?
La farmacovigilancia es el conjunto de actividades orientadas a la detección, evaluación, comprensión y prevención de los efectos adversos o cualquier otro problema relacionado con el uso de medicamentos. Su objetivo principal es garantizar la seguridad de los pacientes una vez que un fármaco ha sido autorizado y está en circulación.
Esta disciplina actúa como una red de vigilancia postcomercialización, es decir, se centra en recopilar información real del uso de los medicamentos en condiciones normales, fuera de los ensayos clínicos. Los datos obtenidos permiten identificar riesgos no detectados previamente, actualizar fichas técnicas y, en casos extremos, retirar medicamentos del mercado.
La farmacovigilancia está regulada por organismos nacionales e internacionales, y cuenta con protocolos estandarizados para notificar, clasificar y analizar cada reacción adversa registrada.
¿Por qué es importante la farmacovigilancia?
La farmacovigilancia es fundamental para proteger la salud pública. Su función principal es identificar, evaluar y prevenir los riesgos asociados al uso de medicamentos una vez que ya han sido autorizados y comercializados.
Aunque los fármacos superan rigurosos ensayos clínicos antes de su aprobación, no es hasta su uso generalizado cuando pueden detectarse reacciones adversas raras o inesperadas.
Gracias a los sistemas de farmacovigilancia, las autoridades sanitarias pueden tomar decisiones informadas, como actualizar las condiciones de uso, emitir alertas o, en casos extremos, retirar un medicamento del mercado. Además, esta vigilancia continua refuerza la confianza de los profesionales sanitarios y de la población en el sistema de salud.
En un entorno donde el acceso a tratamientos es cada vez más amplio y global, disponer de mecanismos que garanticen la seguridad, eficacia y calidad de los medicamentos es clave para reducir riesgos y promover un uso racional de los mismos.
¿Cuáles son las etapas de la farmacovigilancia?
Para que un fármaco sea aprobado para uso humano, pasa por una serie de etapas, o ciclo del medicamento:
Fase I: Investigación básica
En esta etapa se plantea una sustancia como posible fármaco y se establece su diana terapéutica, es decir, hacia qué molécula va dirigido el fármaco.
Esta etapa es compleja, ya que el descubrimiento de un medicamento nuevo no es fácil, y es un proceso largo y con una tasa de éxito muy baja. Se estima que solo 250 de cada 10.000 moléculas de la etapa de investigación básica pasan a la fase de investigación preclínica.
Fase II: Preclínica
En esta fase se analiza el compuesto seleccionado en el laboratorio para evaluar la seguridad de su administración en humanos y su actividad biológica. Lo que se pretende es averiguar cómo se distribuye o elimina el medicamento del organismo y conocer sus efectos, a distintas dosis, en diferentes órganos y sistemas, entre otros objetivos.
Para ello, se realizan ensayos en células en cultivo, se formula el medicamento y se hacen estudios de farmacología y toxicología.
Fase III: Clínica
Esta fase de investigación clínica es necesaria para saber cómo actúa el medicamento en las personas y para averiguar si se trata de un medicamento adecuado y eficaz en el tratamiento de la enfermedad, con un perfil de seguridad óptimo.
Es una etapa relativamente larga, donde se demuestra la seguridad del compuesto, se buscan las dosis adecuadas y se evalúan la eficacia y seguridad del tratamiento experimental, sobre una población seleccionada para el estudio. Proporciona la base para la aprobación del fármaco.
Fase IV: Aprobación y Registro
En esta fase se lleva a cabo la solicitud de la autorización para la comercialización del fármaco a las agencias reguladoras competentes.
Fase V: Vigilancia continuada
Una vez autorizado el fármaco y tras su comercialización se hace una vigilancia continuada para estudiar su efectividad y seguridad en la utilización clínica diaria ya que, cuando sale al mercado, su uso se expande a miles-millones de pacientes de todo el mundo, muy diferentes entre sí, produciéndose condiciones y posibles interacciones no identificadas previamente.
Esta es la etapa de farmacovigilancia.
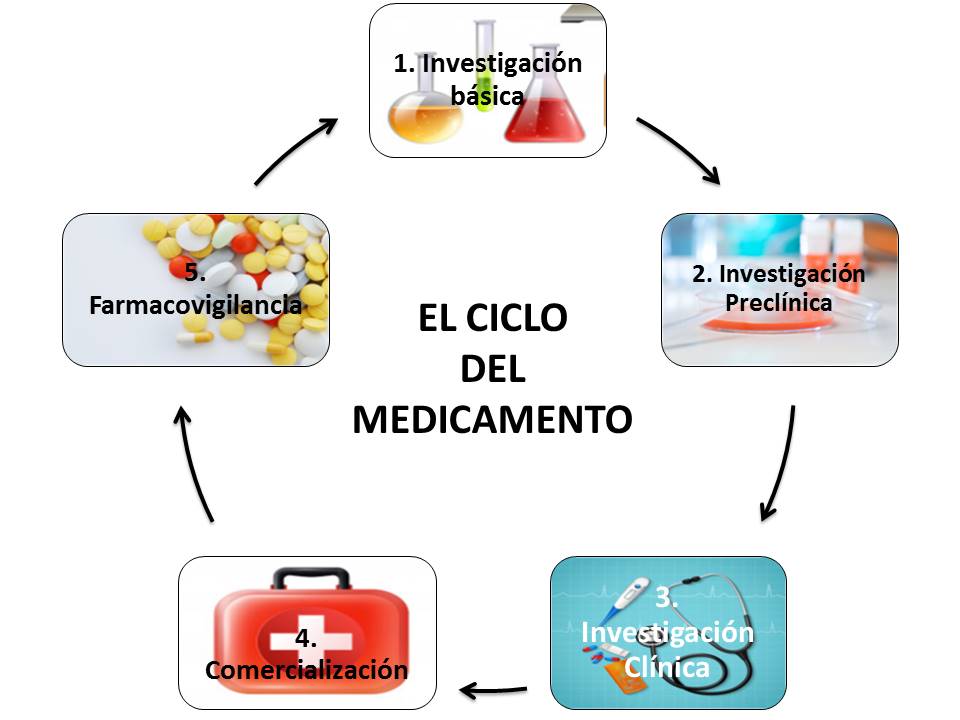
Este seguimiento detallado de las incidencias que pueda generar el producto, permiten modificar la información relativa a las recomendaciones de uso, modificar la información contenida en efectos secundarios y permiten retirar el fármaco del mercado en el caso de que sea necesario. Por eso, garantiza la seguridad de los pacientes.
Ejemplos de farmacovigilancia
La farmacovigilancia se aplica de forma práctica a través de diversos sistemas y procesos que permiten detectar y controlar los efectos adversos de los medicamentos.
Estos son algunos ejemplos reales que ilustran cómo funciona esta disciplina en la práctica:
- Notificación espontánea de reacciones adversas: profesionales sanitarios, farmacéuticos e incluso pacientes pueden reportar posibles efectos secundarios de medicamentos al Sistema Español de Farmacovigilancia o a plataformas europeas como EudraVigilance.
- Retirada de medicamentos: si se detecta un riesgo importante para la salud, las autoridades pueden suspender la comercialización de un fármaco. Es el caso de algunos analgésicos o anticonceptivos que, tras su uso prolongado, mostraron efectos adversos no detectados inicialmente.
- Modificación del prospecto: a partir de los datos recopilados, se actualizan las fichas técnicas para incluir nuevas advertencias, interacciones o recomendaciones de uso.
- Campañas de seguimiento post-comercialización: algunos medicamentos, especialmente los más innovadores, requieren de estudios de seguridad adicionales una vez están en el mercado, lo que se conoce como farmacovigilancia activa.
Estructura digital, automatización y trazabilidad
Hoy en día, gran parte de los procesos de farmacovigilancia están soportados por sistemas digitales que permiten automatizar la recolección, análisis y almacenamiento de datos. La trazabilidad juega un papel clave en la seguridad del paciente, ya que permite rastrear cada lote de medicamento desde su producción hasta su administración.
Estos sistemas permiten:
- Recoger datos en tiempo real desde múltiples fuentes (hospitales, farmacias, plataformas digitales).
- Detectar patrones o señales de alerta mediante inteligencia artificial y algoritmos de cribado.
- Rastrear lotes específicos de medicamentos ante posibles defectos o problemas de calidad.
Esta automatización no solo mejora la eficiencia del sistema, sino que también reduce los tiempos de respuesta ante incidentes, mejorando la protección del paciente.
Digitalización, clasificación, recuperación y seguridad
La digitalización ha transformado la farmacovigilancia en una disciplina más ágil, interoperable y segura.
Hoy en día, los informes de sospechas de reacciones adversas se registran en bases de datos centralizadas que permiten su análisis y consulta por parte de las autoridades sanitarias de todo el mundo.
Además, los sistemas modernos incluyen:
- Clasificación automática de incidencias según nivel de gravedad o urgencia.
- Recuperación de información histórica para análisis de tendencias y elaboración de informes regulatorios.
- Mecanismos de encriptación y acceso seguro para proteger los datos sensibles de pacientes y profesionales.
Este enfoque digital refuerza la vigilancia sanitaria, permite tomar decisiones más rápidas y facilita la cooperación internacional en materia de seguridad farmacológica.
¿Quién participa en la farmacovigilancia?
Es cosa de todos. Se trata de una responsabilidad compartida por las autoridades sanitarias, por la industria farmacéutica, por los profesionales sanitarios y por los propios ciudadanos.
Su éxito reside en la colaboración de todas las partes involucradas.
El Sistema Español de Farmacovigilancia apareció ante la necesidad de vigilar los posibles problemas relacionados con el uso de los medicamentos. En España la antigua Ley del Medicamento de 1990 ya recogía la importancia de que los profesionales de la sanidad participaran en la protección de la salud, pero no es hasta el año 2002 cuando se regula por ley (RD 711/2002, de 19 de julio). Actualmente ese RD 711/2002 ha sido derogado y sustituido por el Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano.
Los médicos, farmacéuticos, enfermeros y demás profesionales de la salud tienen la obligación de notificar toda sospecha de reacción adversa a medicamentos, y enviarla de manera urgente al correspondiente Centro Autonómico de Farmacovigilancia.
Tras la notificación, el comité técnico de farmacovigilancia de la Agencia, evalúa la importancia de la reacción y adopta las medidas adecuadas que pueden llegar a la retirada temporal o definitiva del medicamento y, por supuesto, informa a todos los agentes sanitarios implicados.
Aunque son las autoridades competentes las que deben informar y actuar en caso de descubrir una posible reacción adversa, los pacientes también deben notificar a su médico o farmacéutico cualquier reacción aparentemente relacionada con un medicamento que esté utilizando, para contribuir activamente a la seguridad de todos.
La farmacovigilancia nos garantiza la seguridad de un medicamento, ya que garantiza que el efecto adverso detectado tiene una incidencia mucho menor que el beneficio de la administración del mismo.

Farmacovigilancia de las vacunas
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), valora permanente las sospechas de reacciones adversas notificadas en España con todos los medicamentos autorizados, incluyendo las vacunas.
Las vacunas son medicamentos particulares y su regulación también. Al vacunarse millones de personas, es necesario conocer cualquier acontecimiento adverso que ocurra un tiempo después de la vacunación y analizar, entre otros factores, si ocurre con más frecuencia que lo que se espera que ocurra en general en la población.
Por eso se recoge cualquier acontecimiento adverso asociado temporalmente tras su administración, sin que exista la sospecha de que la vacuna pueda haberlo originado, ya que puede tratarse de problemas médicos que coinciden en el tiempo o que estén relacionados con el propio acto de la vacunación.
En caso de que el número de acontecimientos que se recoja tras la vacunación sea superior a lo que esperamos que ocurra en la población, se realiza una evaluación amplia y detallada con toda la información disponible en la UE; las notificaciones recogidas en España forman parte de las evaluaciones europeas.
Así, la AEMPS, organismo público e independiente, junto con el resto de agencias de la UE y la coordinación de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés), realiza una evaluación continuada de los datos para detectar reacciones adversas no identificadas durante los ensayos clínicos de las vacunas.
Por lo tanto, la farmacovigilancia garantiza que todo medicamento autorizado para uso humano, incluidas las vacunas, son seguros y que la probabilidad de que se produzca un efecto adverso es mínima, siendo siempre mucho mayor el beneficio aportado por el tratamiento.
Fórmate en farmacovigilancia
La farmacovigilancia es un área en expansión dentro del sector sanitario y farmacéutico, con una creciente demanda de profesionales especializados capaces de gestionar, analizar e interpretar datos sobre la seguridad de los medicamentos.
Formarse en farmacovigilancia permite adquirir competencias clave en normativa sanitaria, evaluación de riesgos, uso de herramientas digitales y gestión de bases de datos clínicas. Esta formación es especialmente relevante para personas tituladas en farmacia, medicina, enfermería, biotecnología o áreas relacionadas con las ciencias de la salud.
En Femxa ofrecemos cursos gratuitos y especializados en el ámbito sanitario, donde puedes formarte en conceptos clave de farmacovigilancia, seguridad del paciente, gestión documental y normativa aplicable. Todo ello con una metodología flexible, tutorizada y adaptada a las necesidades del sector.
Así, podemos concluir que la farmacovigilancia:
- Es una actividad de salud pública cuyo objetivo es la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos una vez comercializados.
- Permite el seguimiento de los posibles efectos adversos de los fármacos.
- Proporciona de forma continuada la información sobre la seguridad de los medicamentos.
- Posibilita la adopción de las medidas oportunas.
- Asegura que los medicamentos disponibles presentan una relación beneficio-riesgo favorable para las personas.
- Garantiza la seguridad de los medicamentos que consumimos.




